
蔡英文視察高端疫苗~中國時報攝
版主之所以找這些資料,是因為民進黨跟1450最近大規模發動針對台灣自己民眾的「認知作戰」,還有很多綠營人士發表關於新冠疫苗的假消息,所以版主今天為大家整理一下現在市面上主要使用及通過WHO認證的新冠疫苗,讓大家有清楚的比較,不要再被綠營騙了!
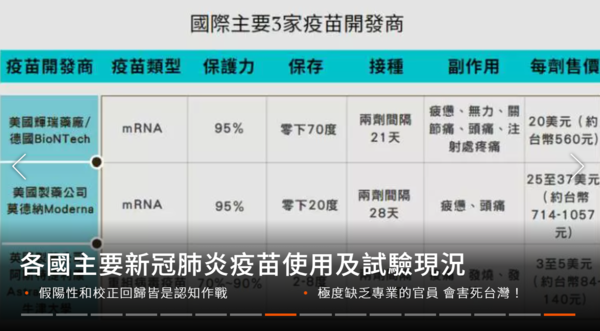
輝瑞﹨BNT﹨復必泰疫苗
輝瑞製藥與BioNTech於2020年11月18日公布疫苗在第三期臨床測試的有效率達到95%,隨後於11月20日向美國食品藥物管理局(FDA)申請緊急授權使用許可,美國食品藥物管理局於12月11日宣布批准緊急使用BNT162b2疫苗,並於2020年12月31日成為世界衛生組織首款核准使用的預防嚴重特殊傳染性肺炎疫苗。輝瑞與BioNTech在2021年4月1日發表跟進接種者6個月的研究報告,在收集12,000名完成兩劑疫苗注射並超過6個月的人士的數據進行分析後,顯示疫苗在現實世界的有效率為91.3%,並且沒有出現嚴重副作用,而有效率在所有年齡、性別及種族都大致相同。
目前綠營在網路上的認知作戰是,告訴台灣民眾上海復星賣的BNT疫苗, 中文名稱復必泰是在中國生產,且是BNT停止開發的BNT162b1候選疫苗,但事實上海復星代理的疫苗是BNT162b2,而且是在德國生產。最近南投縣長想買上海復星代理的BNT疫苗,結果行政院中部聯合服務中心執行長蔡培慧說,輝瑞送到中國的是疫苗原液,所以要分裝,就像手機組裝一樣要代工,還說這種代工疫苗才叫做復必泰?實在讓人覺得此人水準低,連常識也缺乏!其實一查就知道,上海復星只有代理BNT疫苗,目前也都在德國生產,銷給上海復星的BNT中文包裝名稱就叫復必泰,就像Panadol在台灣賣包裝就叫普拿疼一樣!另外,BNT疫苗在出貨玻璃瓶中就是濃縮原液,只有在施打時必須稀釋,出貨並不需要分裝,蔡培慧能夠找到沒人證實的資料,就請她公布一下證據吧!
莫德納嚴重特殊傳染性肺炎疫苗(代號:mRNA-1273,商品名:Moderna COVID‑19 Vaccine,簡稱:莫德納疫苗﹚
美國國家過敏和傳染病研究所、生物醫學高級研究與開發管理局和莫德納合作開發的嚴重特殊傳染性肺炎疫苗,為一種信使核糖核酸(mRNA)疫苗,在2020年12月發表的第三期臨床試驗報告顯示該疫苗的有效率達94%。該疫苗需要以肌肉注射方式接種兩次,每次的劑量為0.5毫升,兩次之間相隔4週。2020年12月18日,mRNA-1273獲得美國食品藥品管理局核發緊急使用授權,其後在2020年12月23日在加拿大、2021年1月6日在歐盟、2021年1月8日在英國,獲發出緊急使用授權。世衛組織於2021年4月30日將該疫苗列入緊急使用清單。莫德納在2021年4月13日表示,追蹤超過3萬名已經接種兩劑疫苗的第三期臨床試驗參與者6個月後,至4月9日有900宗確診個案,顯示疫苗在6個月後的整體有效率仍達到90%,而預防重症的效力則為95%。
牛津-阿斯利康嚴重特殊傳染性肺炎疫苗(商品名:Vaxzevria、Covishield,簡稱阿斯利康疫苗、牛津疫苗、AZ疫苗,代號AZD1222)
英國牛津大學與阿斯利康製藥合作研發,以非複製型病毒載體為技術基礎,是一款針對嚴重特殊傳染性肺炎的預防疫苗,英國藥品及保健品管理局於2020年12月30日批准該款疫苗的緊急授權使用許可,歐洲藥品管理局亦於2021年1月30日批准該款疫苗在歐盟使用,該款疫苗於2021年2月15日獲世界衛生組織列入緊急使用清單,並成為世衛組織全球疫苗分配計劃(COVAX)首種發放的疫苗。這種疫苗的生產地在全球分布廣泛,包括英國、比利時、荷蘭、義大利、印度、韓國、日本、澳洲等國家。阿斯利康疫苗在涵蓋2.4萬人的第三期臨床測試中,有效率平均達到70.4%,最高可達90%。
嬌生嚴重特殊傳染性肺炎疫苗(英語:Johnson & Johnson COVID-19 vaccine)
由位於荷蘭萊頓的楊森疫苗及其比利時母公司同時也是美國嬌生公司的子公司楊森製藥研發的嚴重特殊傳染性肺炎疫苗。
它是一種基於人類腺病毒的病毒載體疫苗,人類腺病毒經過改造後會含有能產生嚴重急性呼吸道症候群冠狀病毒2型病毒尖峰蛋白的基因。人體的免疫系統會對這種尖峰蛋白產生反應並產生抗體。人類只需注射一劑該疫苗,且該疫苗無需冷凍保存。
該疫苗的臨床試驗於2020年6月開始,三期試驗涉及約4.3萬人。2021年1月29日,楊森公司宣布,在疫苗接種28天後,該疫苗預防嚴重特殊傳染性肺炎的有效率為66%,預防重症嚴重特殊傳染性肺炎的有效率為85%,預防嚴重特殊傳染性肺炎引起的住院或死亡的有效率為100%。
該疫苗於2021年2月27日獲得美國食品藥品監督管理局的緊急使用授權,2021年3月11日獲得歐洲藥品管理局的有條件上市授權。
看完歐美疫苗,我們來看看大陸經過WHO認證的疫苗
國衛疫苗﹨眾愛可維(代號:BBIBP-CorV )
中國醫藥集團北京生物製品研究所(BBPI)研發的一款2019冠狀病毒病疫苗,該疫苗採用滅活SARS-CoV-2病毒(Vero細胞)技術,獲得有世界衛生組織緊急使用認證
2020年7月16日,國藥集團開始在阿拉伯聯合大公國對31000名志願者進行三期疫苗試驗。2020年12月9日,阿聯衛生部表示三期臨床試驗數據的中期分析顯示該疫苗有效率達到86%,中和抗體陽轉率99%,預防中度和重度病例有效性為100%,並宣布阿聯正式批准註冊該疫苗。2020年9月,巴林參與了該疫苗的三期臨床試驗,巴林王儲以志願者身份帶頭接種,約7700餘名志願者參與此次疫苗臨床試驗。除阿聯、巴林外,該疫苗還在埃及和約旦進行了三期臨床試驗。
以上就是通過WHO認證的新冠疫苗,這些疫苗通通都做過三期試驗且結果合乎WHO的標準。那麼台灣的疫苗呢?
台灣目前有聽說的兩支疫苗分別是高端及聯亞,至2021年5月為止,這兩支疫苗都只完成第二期人體試驗約4000~5000人的注射,且結果尚未公布。但是蔡英文卻已經告訴國人七月要開打了?這兩支連三期都沒做的疫苗,如果台灣批准緊急使用,其實也就是拿台灣人來做三期試驗,版主相信會有人願意當白老鼠,但版主是絕對不會嘗試的!
PS;WHO認證疫苗的標準很簡單,第一就是疫苗效力須達50%以上,第二就是生產過程必須符合一定標準。聽起來簡單但目前也只有上述幾個疫苗達標!台灣的疫苗想跳過三期獲得認證的可能性幾乎是零!
限會員,要發表迴響,請先登入
- 11樓. 不可能任務2021/05/31 11:51謝大金河今天的文章把引進BNT 打成中共因素 哈哈挺綠的謝先生這樣說, 一點都不意外! 丹尼爾(Dan In TW) 於 2021/05/31 13:33回覆
- 10樓. 草山2021/05/27 14:06
就是個想要靠吹捧當權者拿到好處的可憐蟲?
用蘇信兄的話,小心被蔡18借人頭一用」,所以箭頭指向可憐蟲,大家看戲!
應該還不至於, 要被利用, 還得有那個價值!
這個焦糖最多只是轉貼一些認知障礙的廢文, 搖旗吶喊求關注, 或是噁心跟大小姐搖搖尾巴
結果是,沒人在乎他!
丹尼爾(Dan In TW) 於 2021/05/27 15:33回覆 - 9樓. 草山2021/05/27 11:23就是個想要靠吹捧當權者拿到好處的可憐蟲 丹尼爾(Dan In TW) 於 2021/05/27 13:26回覆
- 8樓. 草山2021/05/27 09:49
雖說拖拉,搶功比超人還快,前陣子蕭美琴出來說美國6月給疫苗,網路一片馬屁聲,如今AIT出說SORRY!不知道馬屁蟲那邊去了?
其實這些貨色都差不多, 像蕭美琴, 范雲, 王定宇...等等, 被打臉就閉嘴了, 更等而下之的就像焦糖XX那種! 丹尼爾(Dan In TW) 於 2021/05/27 09:57回覆拜登跟民進黨的仇,恐怕沒那麼容易化解! 丹尼爾(Dan In TW) 於 2021/05/27 10:12回覆 - 7樓. 14502021/05/27 09:36
蔡政府對進口疫苗極度拖拉,
高官們是怕他們的高端及聯亞的股票變廢紙吧!
二期只表示打了不會死,
沒有三期的三萬人測試,先不談免疫效果如何,
WHO沒認證 國人出國很不方便的!
確實如此! 丹尼爾(Dan In TW) 於 2021/05/27 09:38回覆打了會不會死在一期就要驗證了! 丹尼爾(Dan In TW) 於 2021/05/27 09:39回覆 - 6樓. 安心2021/05/27 09:31“核准”就是可以有很多政治考量了!
在台灣因為沒有大規模爆發病例,所以不具備驗證條件,事實上不能進行有效的第三期試驗,只不過,政治手法就可以了!三期不是想做就能做的! 要看二期的試驗有沒有達到標準, 通常二期就需要幾個月的觀察, 以現在高端及聯亞都只完成二期收案, 到七月只剩兩個月, 是能觀察出甚麼?別人花時間做都是白癡?
在進行第一期臨床試驗時,通常會選擇健康且免疫功能健全的成人當作受試者,但人數不多,主要是評估疫苗施打於人體內的安全性及耐受性,在試驗設計上,大多數的第一期臨床試驗,為開放性設計,且可採用單一劑量組別,或多劑量組別設計,若是選擇後者,可依不同劑量組別的初步免疫原性資料,來評估接下來臨床試驗的選取劑量,而因為所有新開發的疫苗,它的安全性資料十分有限,所以應積極追蹤受試者可能產生的不良反應,以提早因應。
第二期臨床試驗的目的,是進一步探討疫苗的免疫原性與安全性,並找出目標族群的最適合施打劑量、投予方式、投予時程,且受試者人數會比第一期來得多,實驗設計會採用劑量組別設計,並以隨機分配、對照、平行設計來實驗,可同時評估不同劑量之間的免疫原性與安全性,而免疫原性同時也是第二期臨床試驗主要的評估指標,可當作之後劑量選擇以及劑型選擇的參考依據。
丹尼爾(Dan In TW) 於 2021/05/27 09:36回覆
在完成前兩期臨床試驗之後,就可進入第三期臨床試驗,主要目的在確認疫苗的療效與安全性,以利疫苗能順利上市,此階段試驗通常設計為雙盲、前瞻性、隨機分配的實驗模式,並有安慰劑可對比其療效,以利評估施打之後的安全有效性,也會針對特殊族群來做試驗,像是懷孕婦女,來進行免疫原性試驗,有時還會評估此新開發的疫苗,若與其它疫苗同時施打,是否會有互相干擾之情形。 - 5樓. 草山2021/05/27 09:24
義和拳大師兄的咒語「天靈靈,地靈靈,奉請祖師來顯靈。一請唐僧豬八戒,二請沙僧孫悟空,三請二郎來顯聖,四請馬超黃漢升,五請濟顛我佛祖,六請江湖柳樹精,七請飛鏢黃三太,八請前朝冷於冰,九請華佗來治病,十請託塔李天王。金吒木吒三太子,帶領天上十萬兵。這個就是大名鼎鼎的「刀槍不入」咒」
蠻長的,臺灣綠營咒語「攏系阿共仔不好」只有七字,不用大腦,比義和拳大師兄短得多,難怪腦袋退化成那樣子!
如果大陸生產就不能用, 那麼綠營的人恐怕每個人都裸體, 而且家徒四壁! 丹尼爾(Dan In TW) 於 2021/05/27 09:30回覆 - 4樓. 安心2021/05/27 09:09說打臉林明溱,結果咧!是連甚麼就緊急及例外管理都不懂的綠委!
藥事法
林靜儀及側翼 欺負全台灣人不懂法律,明明就能專案輸入
第 48-2 條
有下列情形之一者,中央衛生主管機關得專案核准特定藥物之製造或輸入
,不受第三十九條及第四十條之限制:
一、為預防、診治危及生命或嚴重失能之疾病,且國內尚無適當藥物或合
適替代療法。
二、因應緊急公共衛生情事之需要。
有下列情形之一者,中央衛生主管機關得廢止前項核准,並令申請者限期
處理未使用之藥物,並得公告回收:
一、已有完成查驗登記之藥物或合適替代療法可提供前項第一款情事之需
要。
二、緊急公共衛生情事已終結。
三、藥物經中央衛生主管機關評估確有安全或醫療效能疑慮。
第一項專案核准之申請條件、審查程序、核准基準及其他應遵行事項之辦
法,由中央衛生主管機關定之。重要在核准二字!
丹尼爾(Dan In TW) 於 2021/05/27 09:15回覆 - 3樓. 安心2021/05/27 08:52蔡政府白天打假 晚上側翼網軍裝小粉紅作賊喊抓賊? 國民大會 20210525 (1/4):https://youtu.be/p7yiveZd1so
我有跟官員踢了二十年公文的經驗,官字兩個口,有很多法律及非法律障礙手法可以玩,現在就是要阻截藍白在疫情防治建功,所以講一堆中國、世衛、提出申請、藥證、經濟規模、保存期限的理由,現在又般出醫藥法令,不許地方自行採購,要中央統籌才可以,反正就是要拖到綠政府買的充足以後,就會讓藍白現在爭取的開綠燈了!
其實緊急狀態,本就可以直接的繞過醫藥法,直接授權地方洽購,就向地震、水災、氣爆時,也有緊急應變處理好的,而不是要甚麼都依法申請、驗證。更何況BNT都已經世衛及歐美日驗證施打幾個月了!根本就可以先一邊開放給地方進行洽購,然後一邊讓地方緊急補正藥證程序。現在講一堆理由,這就是政治干擾,不然又是甚麼樣?
所以說“民不與官鬥”,就是這樣。自己人要買就一路開綠燈, 不想讓別人買就用程序搞鬼逼死對手! 丹尼爾(Dan In TW) 於 2021/05/27 08:56回覆 - 2樓. 上大人-真實世界2021/05/27 08:14通過WHO認證
台灣只有給畜牲用的疫苗廠吧?
























