資料來源與版權所有:中央健康保險署
健保113年12月起再通過多項醫療服務納入給付 守護全民健康
中央健康保險署(以下簡稱健保署)自113年12月1日起新增修訂30項醫療服務診療項目納入給付,包括7類癌症單基因檢測、「B型肝炎病毒核心相關抗原(HBcrAg)合併表面抗原(HBsAg)定量檢驗」及用於治療主動脈瓣膜疾病之尾崎式手術(Ozaki procedure)等,預估一年約6.6萬人受惠。
健保署表示,繼本(113)年5月新增12種癌症的次世代基因定序(NGS)檢測,再新增7類癌症的單基因檢測,輔助臨床醫師為病人制定個人化的治療方案,預估每年再嘉惠約1萬名癌症病人,挹注約1億點。考量B型肝炎停藥後之高復發率為一大臨床挑戰,透過新增給付HBcrAg檢測能評估肝細胞內的cccDNA活性,提供臨床判斷停藥的重要依據,降低停藥後猛爆性肝炎及相關併發症風險,預估每年3.4萬人受惠。
健保署表示,攝護腺癌為國人癌症死亡排名第五位,為輔助提升攝護腺癌診斷準確度,新增給付「二胺基酸攝護腺特異抗原前驅物(p2PSA)檢測」,用於區分良性攝護腺疾病與攝護腺特異抗原(PSA)濃度處於灰色地帶的攝護腺癌病人,避免不必要的手術切片,減少併發症的風險,預估每年1.9萬人受惠;針對主動脈瓣膜疾病的患者,新增「尾崎式手術」(主動脈瓣之自體/人工心包膜新瓣葉重建手術)給付,相較於傳統治療方式,手術時間短、再手術率低,為18歲以下符合適應症之病童提供創新且更安全的治療選擇,預估每年13人受惠,挹注5百萬點。
健保署表示,醫療科技日新月異,將持續配合新醫療技術發展及臨床照護需求,編列新醫療科技預算以新增或修訂醫療服務診療項目,並與醫界專家、付費者代表等共同努力,提供最新醫療技術,提升醫療服務品質,守護民眾健康。
------------------------------------------------------------------
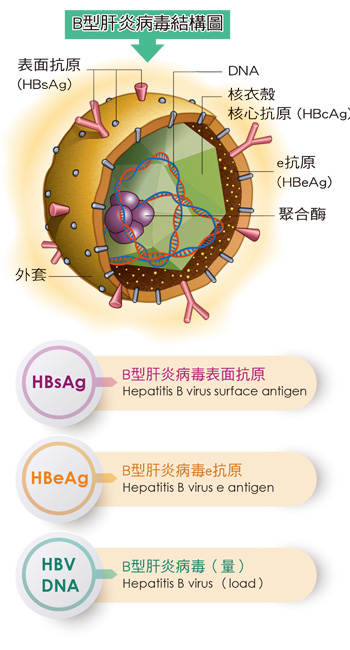
B 型肝炎病毒核心關連抗原合併表面抗原定量檢驗(HBcrAg/HBsAg(Quant.))
檢驗方法
化學冷光酵素免疫分析法(Chemiluminescent enzyme immunoassay,CLEIA),Fujirebio Lumipulse G1200
生物參考區間
HBcrAg: <3 LogU/mL;
HBsAg(Quant.): <0.005 IU/mL
適應症
定量血清中 HBcrAg 及 HBsAg 濃度,協助 B 型肝炎感染輔助診斷與治療效果監控。
臨床意義
目前已知在感染慢性B型肝炎過程中,HBV病毒數量會產生改變,且其病毒量與B肝的感染力及治療後的預後(prognosis)是有相關性的。依據研究指出,血清中HBV核心關連抗原(Hepatitis B core-related antigen, HBcrAg)檢測可用來作為HBV感染的標記,且不易受抗病毒藥物及免疫複合體的影響。HBcrAg則有HBeAg、 HBcAg(HBV核心抗原)及具有分子量22Kd的p22cr之稱的HBV前核心蛋白三種。
HBeAg、HBcAg與p22cr核心蛋白即使在使用抗病毒藥物(如Lamivudine、Entecavir)抑制HBV DNA合成時,仍能檢測肝內殘存病毒,協助判斷治療效果及停藥時機,並可為慢性肝炎病程提供訊息。HBcrAg測定以血清為檢體,因此比侵入性的肝臟活檢更易於操作且具臨床可行性。
一般會檢測血液中之HBeAg或血液中之HBV-DNA,然而這些方法具有限制因素,當HBeAg與HBeAb形成免疫複合體時,則無法檢測HBeAg。如在服用lamivudine干安能、adefovir干適能或entecavir貝樂克等抗病毒藥物時,使用諸如PCR(聚合酶連鎖反應)和TMA(轉錄介導的擴增)的基因擴增方法,因用藥DNA合成會受到抑制,並會抑制包含HBV DNA的病毒顆粒的釋放,因此,即使肝臟内HBV還存在,使用上述基因擴增法進行的HBV DNA檢測結果有可能呈偽陰性。
HBsAg定量則能反應HBV DNA及肝內cccDNA濃度,與慢性B型肝炎感染階段高度相關。研究顯示HBsAg可區分不同期的慢性B型肝炎感染,並作為非活動性帶原者的血清標記。此外,HBsAg廣泛應用於B型肝炎病毒感染的輔助診斷及監測,包括判斷患者是否康復或成為慢性帶原者。其定量結果能輔助評估治療反應,監控病程進展,並為治療策略提供依據。
整體而言,HBcrAg與HBsAg定量檢測結合使用,有助於提升B型肝炎的診療精準度,包括病情評估、治療監控及停藥決策,為臨床醫師提供可靠的參考依據。
以上資料來源:https://www2.cch.org.tw/labsearch/Data/2081/113030.pdf
下一則: 長庚醫院跨林口、基隆院區重磅研究~證明「固定療程 B 肝治療」可以大幅減少肝癌 增加病毒清除 延長生命
限會員,要發表迴響,請先登入









