物化第一章 氣體的性質
氣體的基本量: 壓力, 溫度
熱力第零定律: A系統與B系統達成熱平衡,若C系統與B也達成熱平衡.那麼C也會與A達成熱平衡
氣體表示式: pV=nRT, p:壓力, V:體積, T:溫度, n:氣體質量, R:氣體常數
遵守氣體方程式的氣體稱為理想氣體,氣體方程式可視為狀態函數之一
Boyles law: V1/p, or pV=constant (for constant n, T), 當p→0時,氣體遵守此定律
分子的解釋基於氣體壓力來自粒子碰撞器壁產生的,當體積減半,粒子密度就倍增,因此碰撞次數也就倍增,氣體施力的平均值(壓力)也就倍增
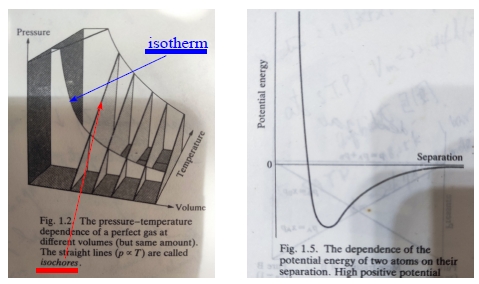
pfVf=piVi (for constant n, T), 每一個溫度的pV曲線稱為isotherm等溫線, Fig. 1.2.
Gay-Lussacs law: VT (for constant n, p), p T (for constant n,V)
Vf=(Tf/Ti )Vi (for constant n, p), pf=(Tf/Ti )pi (for constant n,V)
真實氣體的不完美
分子間的相互作用: 中長距離時,分子有吸引力;距離非常接近時,分子間產生斥力,如U-r曲線所示, Fig.1.5.
真實氣體與理想氣體之間,可以壓縮因子Z來比較,因為pVₘ=RT, where Vₘ=V/n
Z=pVₘ/ RT, e.g. Z=1 for ideal gas
(i)在高壓時,所有氣體Z>1,比理想氣體更難壓縮,分子間的斥力在主導
(ii)at intermediate pressure, 有一些氣體Z<1, span="" style="font-family:標楷體 , cursive" data-mce-style="font-family: 標楷體 , cursive;">表示分子間的吸引力在主導,利於壓縮
真實氣體行為的分析: 真實氣體處於高溫和低密度的條件下, 其等溫線遵守pVₘ=RT,但從實驗的等溫線(Fig.1.7.)得知並不簡單,狀態方程式形式可為:
pVₘ=RT(1+Bp+Cp²+...) or pVₘ=RT(1+B/Vₘ+C/Vₘ²+...), virial係數: B,C,B,Cf(T)
Boyle 溫度,TB: 當係數B=0, pVₘ≈RT其他Cp²和高次項太小可忽略不計
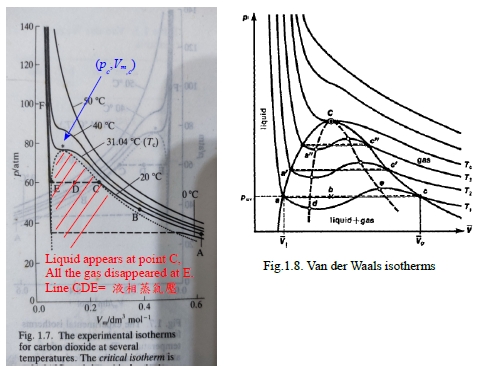
臨界常數, Tc pc Vₘc : Tc 等溫線上有一臨界點(pc,Vₘc),在Tc 以上的等溫線不會出現液相;而Tc以下的等溫線會有水平線(液相凝結)出現,臨界點(pc,Vₘc)即是水平線兩端互相重合的奇點
真實氣體方程式: 由於virial equation, pVₘ=RT(1+Bp+Cp²+...)太複雜,我們以van der Waals eq.作為近似真實氣體方程式的表示: (p+an²/V²)(V-nb)=nRT or p=RT/(Vₘ-b)-a/Vₘ²
(i)粒子的體積≠0, nb近似所有粒子的體積總和
(ii)粒子間的吸引力會減少氣體壓力,直接影響碰撞器壁的頻率和輕重,因此減少的壓力與粒子密度的平方成正比; ∆p(n/V)², ∆p稱為氣體的內壓, ∆p=a/Vₘ²
將van der Waals eq.展開: Vₘ³-(b+RT/p)Vₘ²+(a/p)Vₘ-ab/p=0, 如Fig.1.8.計算的等溫線
van der Waals氣體方程式p=RT/(Vₘ-b)-a/Vₘ²的特徵:
-
Tc以下的等溫線產生的震盪曲線不是實際的情形,實際的情形為一水平線
-
理想氣體的等溫線是處於高溫和低密度的條件下,因為高溫, RT/(Vₘ-b)遠大於a/Vₘ², 低密度的條件可把Vₘ-b視為Vₘ,方程式即變為p=RT/Vₘ
-
Tc以下氣液相共存是因等號右邊的前後項大小接近,互相平衡的結果,RT/(Vₘ-b)代表粒子的動能和粒子間的斥力,a/Vₘ²則是粒子間的吸引力
-
臨界溫度Tc以下的等溫線的震盪曲線會收斂於Tc的等溫線上的反曲點(pc,Vₘc),數學上該點的斜率和曲率均為零, 亦即dp/dVₘ=0, d²p/dVₘ²=0
dp/dVₘ=-RT/(Vₘ-b)²+2a/Vₘ³=0, d²p/dVₘ²=2RT/(Vₘ-b)³-6a/Vₘ⁴=0 →解Tc, pc,Vₘc → Vₘc=3b, Tc=8a/27Rb, pc=a/27b², Z=pcVₘc/RTc=3/8=0.375 vs. 實驗值約0.3
-
Boyle 溫度,TB: 先將van der Waals eq.整理成pVₘ=RT(1+B/Vₘ+C/Vₘ²+...)的形式
p=RT/(Vₘ-b)-a/Vₘ² → p=RT/Vₘ[1/(1-b/Vₘ)-a/RTVₘ], if b/Vₘ<<1, 1="" 1-="" span="" style="font-family:times new roman , serif" data-mce-style="font-family: times new roman , serif;">b/Vₘ)=1+b/Vₘ+(b/Vₘ)²+...
→ p≈RT/Vₘ[1+b/Vₘ+(b/Vₘ)²+...-a/RTVₘ]=RT/Vₘ[1+(b-a/RT)/Vₘ+(b/Vₘ)²+...] ⸫ B=b-a/RT 當B=0時, b-a/RT=0, TB=a/Rb=27Tc/8

ex.1.8 pV=nRT=mRT/M → M=mRT/pV=ρ(RT/p),作圖ρ/p vs. p 外插至p→0的截距(ρ/p)ₚ→₀ M=RT(ρ/p)ₚ→₀=0.0820575298.151.8748=45.88

ex.1.31 barometric fomula p(h)=p₀e-Mₘgh/RT , dp=-ρgdh ⸪pMₘ=ρRT → dp=-pMₘgdh/RT 積分∫ₚ₀ₚdp/p=∫₀ₕ-Mₘgdh/RT → ln(p/p₀)=-Mₘgh/RT → p=p₀e-Mₘgh/RTex.1.25 virial expansion at 273K, pVₘ/RT=1-(21.7cm³mol⁻¹/Vₘ)+(1200cm⁶mol⁻²/Vₘ²)+... 求critical constants? Virial coefficients: B=-21.7, C=1200p=RT/Vₘ[1+(b-a/RT)/Vₘ+(b/Vₘ)²+...], b-a/RT=-21.7, b²=1200 ⸫a=1261, b=C½=34.64Vₘc=103.92cm³mol⁻¹, Tc=131.5K, pc=3.89atm
第二章 第一定律概念
敘述1: 當一系統沿絕熱路徑由A狀態變至B狀態,無論任何方法它做的功都一樣; wad=Uf-Ui
p.s. 絕熱adiabatic: containers that do not permit energy to be transferred as heat, vs. diathermic.
若不是絕熱路徑,熱量heat是內能變化與做功的差值; q=∆U-w or q=wad-w
敘述2: 隔絕系統的能量是固定的; U=U₀, ⸪∆U=q+w & q=w=0
看成微小變化: dU=dq+dw, i.e. dw: work done on system, dq: heat supplied to system.
功: a. 機械功 b.收縮/膨脹功 c. 自由膨脹 d. 定壓膨脹 e. 可逆膨脹
a. 人(系統)對物體作功,由高度zi移到zf(zf>zi); dw=∫zᵢzᶠ-F(z)dz=-(zf-zi)|F| F是重力,方向往下
b. 氣體對抗外部定壓力pex, 膨脹dV; dw=pexdV
c. 當pex=0發生自由膨脹,dw=0
d. 膨脹過程中pex都是固定值, dw=-∫VᵢVᶠpexdV=-pex(Vf-Vi)=-pex∆V
e. 可逆過程: isothermal expansion of a perfect gas, dw=-∫VᵢVᶠpindV=-∫VᵢVᶠ(nRT/V)dV=-nRTln(Vf/Vi)

熱: dTdq or dq=CdT, C: heat capacity; Cₘ=C/n
heat capacity: isochoric Cᵥ at dV=0 & dw=0; isobaric Cₚ at dp=0
1st law: dU=dq+dw=dq+dwₑ-pex∆V,
when ∆V=0 and dwₑ=0 → dU=dq at constant volume, no other work. Implies Cᵥ=(∂U/∂T)ᵥ
ex. van der Waals eq. p=nRT/(V-nb)-an²/V²
(∂p/∂T)ᵥ=nR/(V-nb); (∂p/∂V)T=-nRT/(V-nb)²+2an²/V³
∂²p/∂T∂V=-nR/(V-nb)²; ∂²p/∂V∂T=-nR/(V-nb)² ⸫ ∂²p/∂T∂V=∂²p/∂V∂T
ex. Dieterici eq. p={nRT/(V-nb)}exp(-an/RTV)
(∂p/∂T)ᵥ={nR/(V-nb)}exp(-an/RTV)+{nRT/(V-nb)}an/RT²Vexp(-an/RTV)
={nR/(V-nb)}exp(-an/RTV)[1+an/RTV]
(∂p/∂V)T={-nRT/(V-nb)²}exp(-an/RTV)+{nRT/(V-nb)}an/RTV²exp(-an/RTV)={nRT/(V-nb)}exp(-an/RTV)[-1/(V-nb)+an/RTV²]
∂²p/∂T∂V={-nR/(V-nb)²}exp(-an/RTV)[1+an/RTV]+{nRT/(V-nb)}an/RTV²exp(-an/RTV)[1+an/RTV]+{nR/(V-nb)}exp(-an/RTV)(-an/RTV²)={nR/(V-nb)}exp(-an/RTV){-1/(V-nb)[1+an/RTV]+an/RTV²[1+an/RTV]-an/RTV²}={nR/(V-nb)}exp(-an/RTV){1/(V-nb)[1+an/RTV]+(an/RT)²V³]
∂²p/∂V∂T={nR/(V-nb)}exp(-an/RTV)[-1/(V-nb)+an/RTV²]+{nRT/(V-nb)}an/RT²V exp(-an/RTV)[-1/(V-nb)+an/RTV²]+{nRT/(V-nb)}exp(-an/RTV)[-an/RT²V²]={nR/(V-nb)}exp(-an/RTV){-1/(V-nb)+an/RTV²+an/RTV[-1/(V-nb)+an/RTV²]-an/RTV²}={nR/(V-nb)}exp(-an/RTV){-1/(V-nb)[1+an/RTV]+(an/RT)²V³} ⸫ ∂²p/∂T∂V=∂²p/∂V∂T
Cₚ是甚麼? 先定義H=U+pV, 為了確認dH=(dq)ₚ, 考慮微小變化H+dH=(U+dU)+(p+dp)(V+dV)
→ H+dH=U+pV+dU+Vdp+pdV+dpdV i.e. dpdV太小可忽略
H=U+pV的微分dH=dU+d(pV)=dU+Vdp+pdV, 前面有提到dU=dq+dw=dq+dwₑ-pex∆V 代入
dH= dq+dwₑ+Vdp it means dH= dq at constant volume, no other work. Implies Cₚ=(∂U/∂T)ₚ
H焓在定壓的過程扮演能量傳遞的重要角色,焓與內能的差別是由於系統體積改變產生的功
H=U+pV=U+nRT (ideal gas)→ dH=dU+nRdT ⸪ dU=CᵥdT, dH=CₚdT ⸫ Cₚ-Cᵥ=nR
第三章 第一定律機構
狀態函數與其微分
一般性質的分類依照尺寸大小, extensive性質會與其大小有關, ex. m, q, Cv, V; intensive性質則與尺寸無關, ex. T, ρ, p, Vₘ.
熱力學區分函數有兩種: 狀態函數和路徑函數, 譬如內能和溫度屬狀態函數, 跟其系統的現狀有關,與其前後過程無關;反之,熱與功的多少則與其過程有關,屬於路徑函數
ex. Uᵢ(pᵢ,Vᵢ,Tᵢ)→Uf(pf,Vf,Tf), 從Uᵢ 狀態到Uf 狀態,可由adiabatic或non-adiabatic路徑完成,其中變化的q和w就不同, i.e. Uf-Uᵢ=∆U=∫ᵢᶠdU vs. q=∫ᵢᶠₚₐₜₕdq≠qf-qᵢ

狀態函數的數學特性: 若經過一封閉迴路的過程, 其狀態變化為零, 即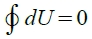
; 同時與積分路徑無關,也符合exact differential的特性
df=gdx+hdy is exact if (∂g/∂y)ₓ=(∂h/∂x)y If df is exact, then its inegral between specified limits is independent of the path.
內能變化: U=U(V,T) U可視為(p,V,T)的函數, p 可以V 和T 表示,所以方便起見,內能U為V 和T 的函數,因此內能變化dU=U(V+dV,T+dT)-U(V,T)=(∂U/∂V)TdV+(∂U/∂T)VdT
偏導數關係: f(x,y), df=(∂f/∂x)ydx+(∂f/∂y)ₓdy and ∂²f/∂x∂y=∂²f/∂y∂x
when z=z(x,y), like p=p(V,T)
relation 1: when x changed at fixed z, (∂f/∂x)z=(∂f/∂x)y+(∂f/∂y)ₓ(∂y/∂x)z
relation 2: (∂x/∂y)z=1/(∂y/∂x)z
relation 3: (∂x/∂y)z=-(∂x/∂z)y(∂z/∂y)ₓ → (∂x/∂y)z(∂y/∂z)ₓ(∂z/∂x)y=-1 Euler chain relation
pf: f(x,y,z)=0, x(y,z) & z(x,y) → dx=(∂x/∂y)zdy+(∂x/∂z)ydz...(a), dz=(∂z/∂x)ydx+(∂z/∂y)xdy...(b)代入(a)
→ dx=(∂x/∂y)zdy+(∂x/∂z)y[(∂z/∂x)ydx+(∂z/∂y)xdy]=dx+[(∂x/∂y)z+(∂x/∂z)y(∂z/∂y)x]dy
⸫ (∂x/∂y)z+(∂x/∂z)y(∂z/∂y)x=0, (∂x/∂y)z=-(∂x/∂z)y(∂z/∂y)ₓ
第一定律: dU=dq+dw, dw=dwₑ-pex∆V or dU=(∂U/∂V)TdV+(∂U/∂T)VdT
H=U+pV, H=H(p,T) → dH=(∂H/∂p)Tdp+(∂H/∂T)pdT
將Cᵥ=(∂U/∂T)ᵥ, Cₚ=(∂U/∂T)ₚ 代入, dU=CᵥdT+(∂U/∂V)TdV, dH=CₚdT+(∂H/∂p)Tdp
內能的溫度關係: dU=CᵥdT+(∂U/∂V)TdV → (∂U/∂T)ₚ=Cᵥ+(∂U/∂V)T(∂V/∂T)ₚ
定義等壓熱膨脹係數, α=(1/V)(∂V/∂T)ₚ ⸫ (∂U/∂T)ₚ=Cᵥ+αV(∂U/∂V)T
what is (∂U/∂V)T? 材料在等溫壓縮時,粒子間的交互作用增加,此交互作用貢獻到系統的內能,猶如van der Waals氣體的a/Vₘ².
pf: dU=TdS-pdV → (∂U/∂V)T=T(∂S/∂V)T-p=T(∂p/∂T)ᵥ-p
(i) ideal gases obey pV=nRT → (∂p/∂T)ᵥ=nR/V, ⸫ (∂U/∂V)T=T(∂p/∂T)ᵥ-p=nRT/V-p=0
(ii) van der Waals gas: p=nRT/(V-nb)-an²/V² → (∂p/∂T)ᵥ=nR/(V-nb)
⸫ (∂U/∂V)T=T(∂p/∂T)ᵥ-p=nRT/(V-nb)-p=an²/V²=a/Vₘ²
焓的溫度關係: dH=CₚdT+(∂H/∂p)Tdp → (∂H/∂T)ᵥ=Cₚ+(∂H/∂p)T(∂p/∂T)ᵥ
由relation 3得, (∂p/∂T)ᵥ=-(∂V/∂T)ₚ/(∂V/∂p)T=-αV/(∂V/∂p)T
定義等溫壓縮係數, κ=-(1/V)(∂V/∂p)T ⸫ (∂H/∂T)ᵥ=Cₚ+(α/κ)(∂H/∂p)T
(∂H/∂p)T也可由Euler chain relation得,
(∂H/∂p)T=-1/(∂p/∂T)H(∂T/∂H)ₚ=-(∂T/∂p)H(∂H/∂T)ₚ=-(∂T/∂p)HCₚ → (∂H/∂T)ᵥ=Cₚ-(αCₚ/κ)(∂T/∂p)H
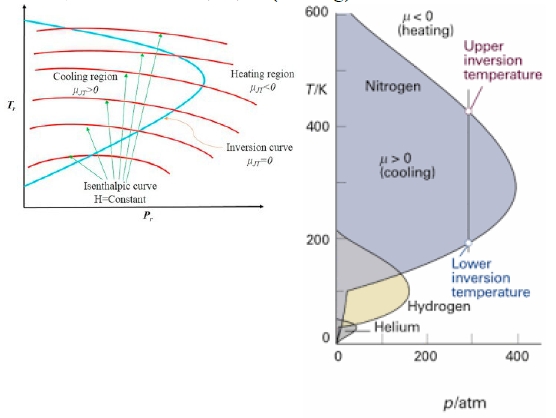
what is (∂T/∂p)H? 定義Joule-Thomson係數, μJT=(∂T/∂p)H, 也稱Joule-Thomson effect

→ (∂H/∂p)T=-μJTCₚ, and (∂H/∂T)ᵥ=Cₚ-(αCₚ/κ)(∂T/∂p)H=Cₚ(1-αμJT/κ)
μJT的意義:
dH=(∂H/∂p)Tdp+(∂H/∂T)pdT=CₚdT+(∂H/∂p)Tdp, as dH=0, (dT/dp)H=-(∂H/∂p)T/Cₚ
dH=TdS+Vdp → (∂H/∂p)T=T(∂S/∂p)T+V=-T(∂V/∂T)p+V 代入上式
→ (∂T/∂p)H=[T(∂V/∂T)p-V]/Cₚ
(i) ideal gases obey pV=nRT → (∂V/∂T)p=nR/p, ⸫ μJT=(∂T/∂p)H=[nRT/p-V]/Cₚ=0
(ii) van der Waals gas: p=RT/(Vₘ-b)-a/Vₘ² → Vₘ=RT/p+b-a/pVₘ+ab/pVₘ² 因為最後二項的值太小可忽略不計,為簡化計算方便故,將Vₘ以RT/p取代: Vₘ=RT/p+b-a/RT+ abp/R²T²
(∂Vₘ/∂T)p=R/p+a/RT²-2abp/R²T³, T(∂Vₘ/∂T)p=RT/p+a/RT-2abp/R²T²,
T(∂Vₘ/∂T)p-Vₘ=RT/p+a/RT-2abp/R²T²-(RT/p+b-a/RT+ abp/R²T²)=-b+2a/RT-3abp/R²T²
μJT=(∂T/∂p)H=[T(∂Vₘ/∂T)p-Vₘ]/Cₚ=(-b+2a/RT-3abp/R²T²)/Cₚ, At low pressure and high temperature 3abp/R²T² term is very small, μJT≈(2a/RT-b)/Cₚ
μJT的正負大小取決於(2a/RT-b), 記住∂p<0 span="">
(i)當2a/RT>b, μJT>0, 所以∂T<0, span="">氣體在降溫(cooling) → 液化氣體
(ii)當2a/RT=b, μJT=0, Tᵢₙᵥ=2a/Rb=2TB
(iii)當2a/RTJT<0, span="">所以∂T>0, 氣體在升溫(heating)
Cᵥ與Cₚ的關係:
Cₚ-Cᵥ=(∂H/∂T)ₚ-(∂U/∂T)ᵥ=(∂U/∂T)ₚ+(∂pV/∂T)ₚ-(∂U/∂T)ᵥ=(∂U/∂T)ₚ-(∂U/∂T)ᵥ+p(∂V/∂T)ₚ
i.e. dU=(∂U/∂V)TdV+(∂U/∂T)VdT→(∂U/∂T)ₚ=(∂U/∂V)T(∂V/∂T)ₚ+(∂U/∂T)V 代入上式
Cₚ-Cᵥ=(∂U/∂V)T(∂V/∂T)ₚ+p(∂V/∂T)ₚ=αV[(∂U/∂V)T+p] ⸪α=(1/V)(∂V/∂T)ₚ
dU=TdS-pdV → (∂U/∂V)T=T(∂S/∂V)T-p=T(∂p/∂T)ᵥ-p 代入上式 Cₚ-Cᵥ= αVT(∂p/∂T)ᵥ
(∂p/∂T)ᵥ=-(∂V/∂T)ₚ/(∂V/∂p)T=α/κ, Cₚ-Cᵥ=(α²/κ)VT 固液相時, α很小可能Cₚ≈Cᵥ, 但κ也很小時 α²/κ會變大,必須回到Cₚ-Cᵥ=αV[(∂U/∂V)T+p],α也許很小,但[(∂U/∂V)T+p]可能很大!
理想氣體的α與κ: idal gas eq. pV=nRT
α=(1/V)(∂V/∂T)ₚ=(1/V)(nR/p)=1/T, κ=-(1/V)(∂V/∂p)T =-(1/V)(-nRT/p²)=(1/p)(nRT/pV)=1/p
Cₚ-Cᵥ=(α²/κ)VT=pVT/T²=nR
絕熱膨脹功 w=-∫ᵢᶠpdV
有時功或熱無法直接得到,可找一有關的狀態函數取最方便的路徑來計算其中的變化
w=∫ᵢᶠdU=∫ᵢᶠCᵥdT 因為(∂U/∂V)T=0 for ideal gas. → w=Cᵥ(Tf-Ti)=Cᵥ∆T
系統做的功=內能降低的變化量, 反映在溫度下降
不可逆條件: ( i) no pₑₓ as expansion, → w=0, ∆T=0 (ii) at fixed pₑₓ, → w=-pₑₓ∆V=Cᵥ∆T, ⸫∆T=-pₑₓ∆V/Cᵥ
可逆條件: 內外壓力p都遵守ideal gas pV=nRT行為, dU=-pdV=CᵥdT
→ CᵥdT=-nRTdV/V, Cᵥ視為與溫度無關, → CᵥdT/T=-nRdV/V 積分
Cᵥ∫ᵢᶠdT/T=-nR∫ᵢᶠdV/V → Cᵥln(Tf/Ti)=-nRln(Vf/Vi) i.e. define c=Cᵥ/nR ⸫ ln(Tf/Ti)c=ln(Vi/Vf)
Tf=(Vi/Vf)1/c Ti → w=Cᵥ∆T=Cᵥ(Tf-Ti)=Cᵥ[(Vi/Vf)1/c-1]Ti
def: γ=Cₚ/Cᵥ and Cₚ-Cᵥ=nR → c=Cᵥ/(Cₚ-Cᵥ), 1/c=γ-1, w=Cᵥ[(Vi/Vf)γ-1-1]Ti
⸪ piVi/pfVf =Ti/Tf=(Vf/Vi)γ-1 → piViγ =pfVfγ
Vi/Vf=(pf/pi)1/γ → w=Cᵥ[(pf/pi)(γ-1) /γ-1]Ti


