Chapter 4 The Statistical Interpretation Of Entropy統計熱力學
古典熱力講巨觀,例如U, S的物理意義,抽象難以了解;Gibbs說: 熵為測量系統混合的程度,混合程度高→熵值大,但為何是『亂度』呢? 微觀下,1 mole=610²³ atoms, 1 cm³≈1 mole 也就是1 c.c.約有10²³個粒子的行為像機率分佈一樣, 而機率最大、最可能的狀態即表現在巨觀上
entropy(S)↔atomic scale “disorder”
Gibbs: S is degree of “mixed-upness” at atomic/molecular scale. 亂度, 熵
e.g. S(ₛ)<S(ₗ)<<S(ᵍ), l → s at Tₘ ∆Sᶠ=S(ₛ)-S(ₗ)<0, melting="" font="">s → l ∆Sₘ=∆Hₘ/Tₘ ∆Hₘ>0 ⸫∆Sₘ>0
l ↔ s at equilibrium ∆Sₘ=0
(1)過冷凝結: 雖然系統亂度下降,但熵卻增加;因為熱儲的亂度增加比系統亂度下降量要大。
(2)平衡凝固點: 總有序度未改變,亂度僅是從系統傳至熱儲,並無增熵,所以為可逆相變化。
“一系統平衡狀態為該系統最可能出現的狀態”,最有可能的微觀狀態決定巨觀平衡狀態
微觀與巨觀狀態的關係: 微觀分布(統計熱力學)↔巨觀(最可能的狀態)
量子理論:能階概念與尺寸有關(e.g. 一維長度決定共振(駐波)的頻率),體積牽涉到微觀的能階,巨觀狀態牽涉微觀的最可能分布

Determination of most probable microstates

當平衡時, Ω=Ωmₐₓ,
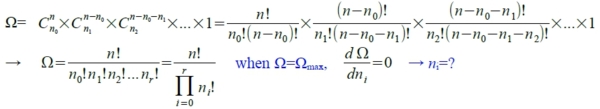
數目龐大,取ln 再處理(Sterling approximation: lnX!≈XlnX-X)
⸫ lnΩ=(nlnn-n)-[(n₀lnn₀-n₀)+(n₁lnn₁-n₁)+...+(nᵣlnnᵣ-nᵣ)]=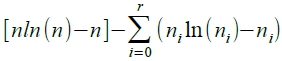
when Ω=Ωₘₐₓ, lnΩ=lnΩₘₐₓ → dlnΩ=0
consraints: 1. fixed V, εᵢ known and fixed. 2. U=Σnᵢεᵢ dU=0 in equilibrium. 3. Total particle number, n=Σnᵢ dn=0
δU=0, δU=Σεᵢδnᵢ=0...(i), δn=Σδnᵢ=0...(ii),
δlnΩ=
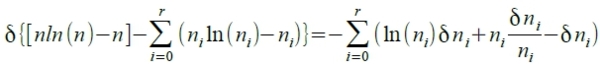
δlnΩ=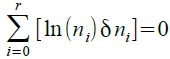 ...(iii)
...(iii)
Q: (i)(ii)(iii)同時成立, nᵢ=?
利用lagrange multiplier method, β(i)+α(ii)+(iii)=0 i.e. α, β均為常數
→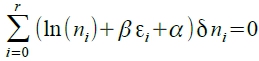
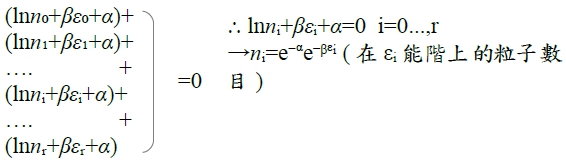
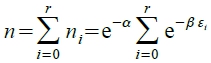 , 令
, 令 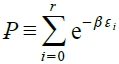 partition function, → n=e⁻αꝐ → α=ln(Ꝑ/n), β=?
partition function, → n=e⁻αꝐ → α=ln(Ꝑ/n), β=?
⸫ nᵢ=(n/Ꝑ)e⁻βε ͥ when n very large, Ωmₐₓ≈Ωtₒtₐl
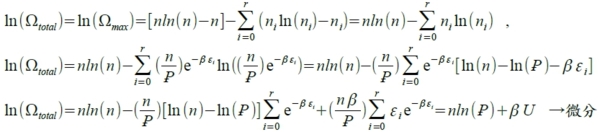
i.e. Σnᵢ=Σ(n/Ꝑ)e⁻βε ͥ , U=Σnᵢεᵢ=Σεᵢ(n/Ꝑ)e⁻βε ͥ
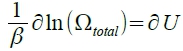 vs. TdS=dUᵥ
vs. TdS=dUᵥ
統計熱力與古典熱力的式子比較之下, Boltzmann給熵一個統計熱力的定義式:S≡kln(Ωtₒtₐl)
S≡kln(Ωtₒtₐl) → dS=kdln(Ωtₒtₐl), dUᵥ=TdS=kTdlnΩ vs. ∂U=(1/β)∂lnΩ,
⸫ β=(1/kT) → ln(Ωtₒtₐl)=nln(Ꝑ)+U/kT
and α=ln(Ꝑ/n) i.e. 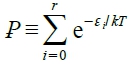 , nᵢ/n=(e⁻ε ͥ /kT)/Ꝑ k∙nᴀ=R 氣體常數
, nᵢ/n=(e⁻ε ͥ /kT)/Ꝑ k∙nᴀ=R 氣體常數
小結: 2nd law: dSᵤ,ᵥ≥0, when equilibrium, Sᵤ,ᵥ=Sₘₐₓ. S即表示亂度(randomness, mixed-up-ness)
Boltzmann定義 S≡kln(Ωtₒtₐl)
考慮一個系統,體積固定(dV=0)表示能階固定(ε₀, ε₁, ε₂, …,εᵢ),含有n個粒子,有固定的內能(dU=0),當平衡時,
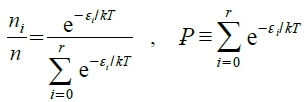

Heat flow: 兩密閉系統A, B(Tᴀ>Tᴃ), 當A,B接觸最後溫度相等( Tᴀ=T=Tᴃ)
Ω=Ωₘₐₓ as equilibrium, it means A×Bmax. 熱流停止, 表示δlnAB=0=δq/kT=dUᵥ/kT
對A: 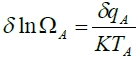 , 對B:
, 對B: 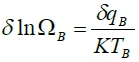 ∵δqA=-δqB=δq<0 Heat flux
∵δqA=-δqB=δq<0 Heat flux
A+B合併: 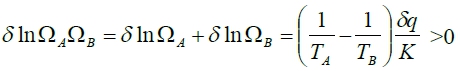 (過程中)
(過程中)
當TA=TB時, A×Bmax. 平衡
Thermal entropy, Sₜₕ: 溫度改變造成entropy改變,因為粒子在能階上重新分布!!
configuration entropy, Sᶜₒₙᶠ: 空間上排列重新分布
e.g. 4A4B填8個位置, 總共有70種排列方式(C⁸₄), 其中最可能的排列分布狀態(C⁴₂C⁴₂=36)
Ex. entropy of mixing, Smᵢₓ
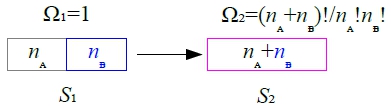
∆S=S₂-S₁=klnΩ₂-klnΩ₁=kln(Ω₂/Ω₁)=kln[(nᴀ+nᴃ)!/nᴀ!nᴃ!]
Sₜₒₜₐₗ=Sₜₕ+Sᶜₒₙᶠ=klnΩₜₕ+klnΩᶜₒₙᶠ=kln(Ωₜₕ∙Ωᶜₒₙᶠ)
若原子不同時, 不但有熱熵還有配列熵(混合位置可分辨數目), 事實上兩件事(熱流和擴散)同時發生; 擴散時原子鍵結能改變(εᴀ₋ᴀ≠εᴀ₋ᴃ)產生熱,造成clustering or oedering.
補充: DeHoff ch. 6 已知能階εᵢ, 可得Ꝑ =Σe⁻ε ͥ /kT, 再從Ꝑ計算S, A, U, cᵥ
前面推導中, 因為lnΩ=nln(Ꝑ)+U/kT → kTlnΩ=nkTln(Ꝑ)+U
S≡klnΩ=nkln(Ꝑ)+U/T, 利用Helmholtz free energy, A=U-TS=U-T(nkln(Ꝑ)+U/T)=-nkTln(Ꝑ)
dA=-SdT-PdV ⸫S=-(∂A/∂T)ᵥ=nkln(Ꝑ)+nkT[∂ln(Ꝑ)/∂T]ᵥ
U=A+TS=-nkTln(Ꝑ)+T{nkln(Ꝑ)+nkT[∂ln(Ꝑ)/∂T]ᵥ}=nkT²[∂ln(Ꝑ)/∂T]ᵥ
cᵥ=(δQ/dT)ᵥ=(∂U/∂T)ᵥ
Ex. 1 mole atoms, and 2 energy levels: ε₁=ε, ε₂=2ε; 求S, A, U, cᵥ
Sol: Ꝑ=e⁻ε/kT+e⁻²ε/kT=e⁻ε/kT(1+e⁻ε/kT) → lnꝐ=-(ε/kT)+ln(1+e⁻ε/kT)
n₁/n=e⁻ε/kT/Ꝑ=1/(1+e⁻ε/kT), n₂/n=e⁻²ε/kT/Ꝑ=1/(eε/kT+1)
*hint: 1. T→0, e⁻ε/kT→0 ⸫n₁/nᴀ→1 whereas eε/kT→∞ ⸫n₂/nᴀ→0
2. T→∞, e⁻ε/kT→1 ⸫n₁/nᴀ→½ whereas eε/kT→1 ⸫n₂/nᴀ→½
U=nᴀkT²[∂ln(Ꝑ)/∂T]ᵥ=nᴀkT²{∂[-(ε/kT)+ln(1+e⁻ε/kT)]/∂T}ᵥ= nᴀkT²[(ε/kT²)+(ε/kT²)(n₂/nᴀ)]=nᴀε+n₂ε
= nᴀε[1+1/(eε/kT+1)]
A=-nᴀkTln(Ꝑ)=nᴀkT[(ε/kT)-ln(1+e⁻ε/kT)]= nᴀε-nᴀkT ln(1+e⁻ε/kT)
Ex. 鉛同位素isotopes的占比, 求Sᶜₒₘₚ?
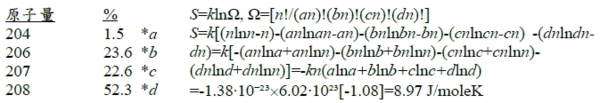
Ex. 氮氣分子光譜有4條,問T=? 是否平衡?
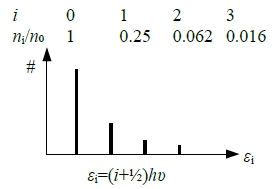
Sol: ⸪ nᵢ/n=(e⁻ε ͥ /kT)/Ꝑ i.e.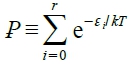
n₁/n₀=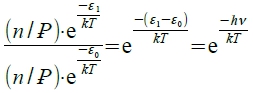 → 0.25=e⁻ℎν/kT T=2420K
→ 0.25=e⁻ℎν/kT T=2420K
If equil. n₀Ꝑ /n= e⁻ε₀/kT=e⁻ℎν/²kT =0.5
n₁Ꝑ /n= e⁻ε₁/kT=e⁻³ℎν/²kT =0.125, n₁/n₀=0.25
n₂Ꝑ /n= e⁻ε₂/kT=e⁻⁵ℎν/²kT =0.031, n₂/n₀=0.062
n₃Ꝑ /n= e⁻ε₃/kT=e⁻⁷ℎν/²kT =0.008, n₃/n₀=0.016 match with experiment, equilibrium!
Gaskell ch. 6-1~6-2. DeHoff ch. 6
內能U, 可推得cᵥ≡(∂U∕∂T)ᵥ=(δQ/dT)ᵥ or δQᵥ=dUᵥ=cᵥdT
If cᵥ(T) known, ∆Q=∫cᵥdT cᵥ(T)=? 也可由cₚ=cᵥ+(TVα²/β) 去求 cᵥ
同理, if cₚ(T) known, ∆Q=∫cₚdT i.e. δQₚ=dHₚ=cₚdT
Given εᵢ, 可推得nᵢ. U=Σnᵢεᵢ=?
◎金屬或共價晶體的內能和cᵥ: 金屬晶格內金屬鍵做震盪,能量存在鍵結中,加總起來成為內能Einstein的假設與模型,以Simple Cubic為例,有N個原子,3維中每個原子有3個自由度可以共振,所以有3N個鍵結.
假設 εi=(i+½)hv, i=0,1,2,3... 頻率v固定
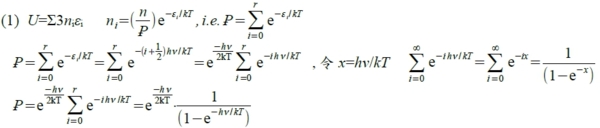
(2) U=3NkT²[∂ln(Ꝑ)/∂T]ᵥ
用上式₽取ln, ln₽=-ℎν/2kT-ln(1-e⁻ℎν/kT) → U=3NkT²[∂ln(Ꝑ)/∂T]ᵥ
= 3NkT²[ℎν/2kT²-(ℎν/kT²∙-e⁻ℎν/kT)/(1-e⁻ℎν/kT)]=3Nℎν/2+3Nℎν[(e⁻ℎν/kT)/(1-e⁻ℎν/kT)]=3Nℎν/2+3Nℎν[1/(eℎν/kT-1)]
→ cᵥ≡(∂U∕∂T)ᵥ=3Nℎν[(ℎν/kT²)∙eℎν/kT/(eℎν/kT-1)²]=3Nk(ℎν/kT)²[eℎν/kT/(eℎν/kT-1)²]
定義Einstein temp. θᴇ≡ℎν/k, cᵥ=3Nk(θᴇ/T)²[eθᴇ/T/(eθᴇ/T-1)²]
結果與實驗比較, cᵥ→3R as T→high temp. and cᵥ→0 as T→0, 中間的誤差起因於假設固定頻率,實際上共振的頻率互相有關,分布在一個範圍
T³ law: θᴆ/T→∞ at low T, 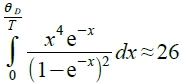 , cᵥ~T³
, cᵥ~T³
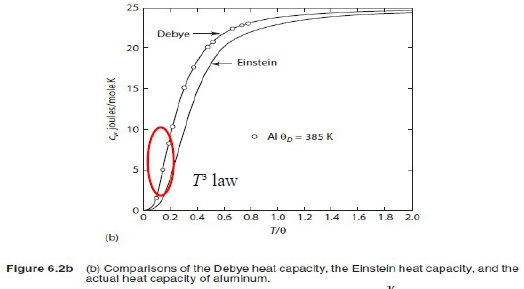
Debye針對頻率做修正,提出『頻譜』g(ν)=(9n/νₘ³) ν² and 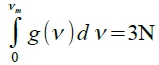
定義Debye temp. θᴆ≡ℎνₘ/k,
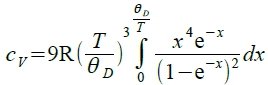
, x=ℎν/kT well fitting with experiment.
計算太複雜! 改由量測cₚ(T)=? 從cₚ=cᵥ+(TVα²/β) 去求 cᵥ? cₚ(T)=a+bT+cT⁻² a,b,c查表
金屬的自由電子對heat capacity的貢獻?

Compound, AₘBₙ: cₚ(AₘBₙ)≈mcₚ(A)+ncₚ(B) Kopps rule
Kopp: 化合物的heat capacity=元素(組成)heat capacity之和
補充: 理想氣體的內能(U)和熱容量(cᵥ)
將U看成所有原(分)子的動能(K.E.),
1. 單原子 K.E.=½∙mvᵢ²=Eₖ
假設一單原子以速度v在(lₓ,ly,lz)的空間中運動, 0<position(x,y,z)<(lₓ,ly,lz) and -∞<(vₓ,vy,vz)<∞
Eₖ= ½∙mv²= ½∙m(vₓ² +vy² +vz ²) → Ꝑ=Σ e⁻εᵢ/kT, εᵢ=½∙m(vₓᵢ² +vyᵢ² +vzᵢ ²)
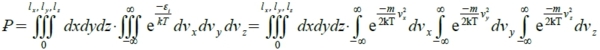
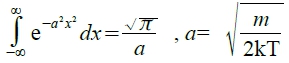 ⸫ ₽=V∙(2πkT/m)½(2πkT/m)½(2πkT/m)½=V∙(2πkT/m)3/2
⸫ ₽=V∙(2πkT/m)½(2πkT/m)½(2πkT/m)½=V∙(2πkT/m)3/2
→ lnꝐ=lnV+(3/2)ln(2kπ/m)+(3/2)lnT ⸪ U=nkT²[∂ln(Ꝑ)/∂T]ᵥ=nkT²(3/2)(1/T)=3nkT/2
If n=Nᴀ, Nᴀ∙k=R ⸫ U=3nkT/2=3RT/2 → cᵥ=(∂U∕∂T)ᵥ=3R/2
證明 Nᴀ∙k=R
dA=-SdT-PdV → P=-(∂A∕∂V)ᴛ and A=-nkTln(Ꝑ) → P=nkT[∂ln(Ꝑ)∕∂V]ᴛ
lnꝐ=lnV+(3/2)ln(2kπ/m)+(3/2)lnT → P=nkT(1/V) 比較 PV=RT if n= Nᴀ ⸫ Nᴀ∙k=R
ex. D=D₀e⁻ε/kT(單一粒子)=D₀e⁻ᴱ/RT(1 mole粒子) Arrehnius eq.
2. diatomic, polyatomic case, U=?
例如: 雙原子除了移動以外,振動和轉動
*3 translation: ½∙m(vₓ² +vy² +vz ²), *1 vibration: ½∙mω²(A²-x²)~bᵥυᵥ² *1 rotation ½∙Iω²~bᵣυᵣ²
→ εᵢ=Σbʲυʲ² j=1, 2,..., n
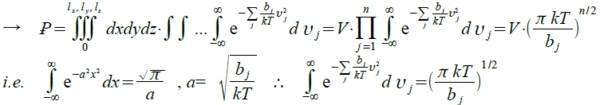
→ lnꝐ=lnV+(n/2)ln(kπ/bʲ)+(n/2)lnT
→ U=NᴀkT²[∂ln(Ꝑ)/∂T]ᵥ=NᴀkT²(n/2)(1/T)=NᴀkT(n/2)=RT(n/2)
"Priciple of equipartition of energy"能量等分原理: each indep. Component of motion contributes to U by ½∙kT(½∙RT)
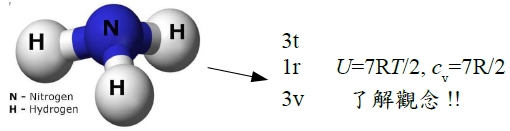
⸫ Diatomic n=5(3t+1r+1v) → U=5RT/2, cᵥ=5R/2 e.g. N₂, O₂, H₂(假設為理想氣體)
實際上, N₂(N≡N) 因為strong bond彈性係數高,振動小→ Eᵥ<Eᵣ<Eₜ cᵥ<5R/2
Ex. NH₃